Obsah
Enzýmy sú kritickými proteínovými molekulami v živých systémoch, ktoré sa po syntéze obvykle nepremieňajú na nejaký iný druh molekuly, ako aj látky prijímané ako palivo pre tráviace a dýchacie procesy (napr. Cukry, tuky, molekulárny kyslík). Je to preto, že enzýmy sú katalyzátory, čo znamená, že sa môžu zúčastňovať chemických reakcií bez toho, aby sa sami zmenili. Trochu ako moderátor verejnej diskusie, ktorá ideálne posúva účastníkov a publikum k záveru diktovaním podmienok argumentu, pričom nepridáva žiadne jedinečné informácie.
Bolo identifikovaných viac ako 2 000 enzýmov a každý z nich je zapojený do jednej špecifickej chemickej reakcie. Enzýmy sú preto špecifické pre substrát. Sú zoskupené do pol tuctu tried na základe druhov reakcií, ktoré sa zúčastňujú.
Základy enzýmov
Enzýmy umožňujú v organizme za podmienok homeostázyalebo celková biochemická rovnováha. Napríklad veľa enzýmov funguje najlepšie pri hladine pH (kyslosti) blízko pH, ktoré si telo normálne udržuje, čo je v rozsahu 7 (tj nie je zásadité ani kyslé). Iné enzýmy fungujú najlepšie pri nízkom pH (vysoká kyslosť) kvôli požiadavkám ich prostredia; napríklad vnútro žalúdka, kde fungujú niektoré tráviace enzýmy, je vysoko kyslý.
Enzýmy sa zúčastňujú procesov od zrážania krvi po syntézu DNA až po trávenie. Niektoré sa nachádzajú iba v bunkách a zúčastňujú sa procesov zahŕňajúcich malé molekuly, ako je napríklad glykolýza; iné sa vylučujú priamo do vnútorností a pôsobia na objemné látky, ako napríklad prehltnuté jedlo.
Pretože enzýmy sú proteíny s pomerne vysokou molekulovou hmotnosťou, každý z nich má odlišný trojrozmerný tvar. To určuje konkrétne molekuly, na ktoré pôsobia. Okrem toho, že je závislá od pH, tvar väčšiny enzýmov závisí od teploty, čo znamená, že fungujú najlepšie v pomerne úzkom teplotnom rozmedzí.
Ako fungujú enzýmy
Väčšina enzýmov účinkuje znížením obsahu aktivačná energia chemickej reakcie. Ich tvar niekedy spája reaktanty fyzicky blízko seba tak, ako je to v štýle trénera športového tímu alebo manažéra pracovnej skupiny, ktorý má v úmysle rýchlejšie vykonať úlohu. Predpokladá sa, že keď sa enzýmy viažu na reaktant, ich tvar sa mení spôsobom, ktorý destabilizuje reaktant a robí ho náchylnejším na akékoľvek chemické zmeny, ktoré reakcia zahŕňa.
Reakcie, ktoré môžu prebiehať bez vstupu energie, sa nazývajú exotermické reakcie. V týchto reakciách majú produkty alebo chemikálie (chemikálie) vzniknuté počas reakcie nižšiu hladinu energie ako chemikálie, ktoré slúžia ako reakčné zložky. Týmto spôsobom molekuly, ako voda, „hľadajú“ svoju vlastnú (energetickú) hladinu; Atómy „uprednostňujú“ usporiadanie s nižšou celkovou energiou, rovnako ako voda steká z kopca do najnižšieho dostupného fyzikálneho bodu. Celkovo je zrejmé, že exotermické reakcie prebiehajú vždy prirodzene.
Skutočnosť, že k reakcii dôjde aj bez vstupu, však nehovorí nič o rýchlosti, akou k nej dôjde. Ak sa látka prijatá do tela prirodzene zmení na dve derivátové látky, ktoré môžu slúžiť ako priame zdroje bunkovej energie, je málo dobré, ak reakcia dokončí prirodzene hodiny alebo dni. Aj keď je celková energia produktov vyššia ako energia reaktantov, energetická cesta nie je na grafe plynulým svahom; namiesto toho musia výrobky dosiahnuť vyššiu úroveň energie ako tá, s ktorou začali, aby sa mohli „dostať cez hrboľ“ a reakcia môže pokračovať. Táto počiatočná investícia energie do reaktantov, ktorá sa vypláca vo forme produktov, je uvedená vyššie aktivačná energiaalebo E.
Druhy enzýmov
Ľudské telo obsahuje šesť hlavných skupín alebo tried enzýmov.
oxidoreduktázy zvýšiť rýchlosť oxidácie a redukcie. Pri týchto reakciách, ktoré sa tiež nazývajú redoxné reakcie, sa jeden z reaktantov vzdáva pár elektrónov, ktoré získa iný reaktant. Uvádza sa, že donor elektrónového páru je oxidovaný a pôsobí ako redukčné činidlo, zatiaľ čo príjemca elektrónového páru je redukovaný, sa nazýva oxidačné činidlo. Zjednodušenejším spôsobom je to, že pri týchto druhoch reakcií sa pohybujú atómy kyslíka, atómy vodíka alebo obidve. Príklady zahŕňajú cytochróm oxidázu a laktátdehydrogenázu.
transferázy rýchlosť pri prenose skupín atómov, ako je metyl (CH3), acetyl (CH3CO) alebo amino (NH2) skupiny, z jednej molekuly na inú molekulu. Acetát kináza a alanín deamináza sú príklady transferáz.
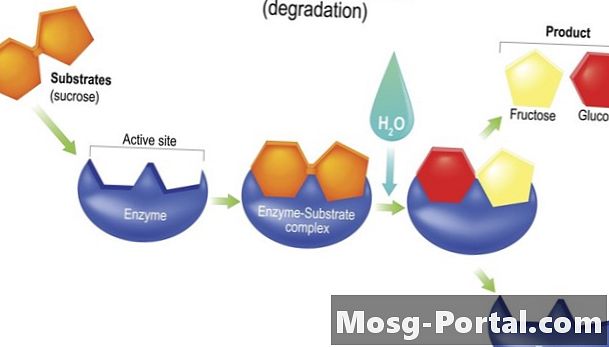
hydroláza urýchliť hydrolytické reakcie. Hydrolytické reakcie používajú vodu2O) rozdeliť väzbu v molekule za vzniku dvoch dcérskych produktov, zvyčajne pripojením -OH (hydroxylovej skupiny) z vody na jeden z produktov a jedného -H (atóm vodíka) na druhý. Medzitým sa z atómov nahradených zložkami -H a -OH vytvorí nová molekula. Tráviace enzýmy lipáza a sukraláza sú hydrolázy.
lyázy zvýšiť rýchlosť pridania jednej molekulovej skupiny k dvojitej väzbe alebo odstráneniu dvoch skupín z blízkych atómov za vzniku dvojitej väzby. Pôsobia ako hydrolázy, s výnimkou toho, že odstránená zložka nie je vytlačená vodou alebo časťami vody. Táto trieda enzýmov zahŕňa oxalát dekarboxylázu a izocitrát lyázu.
izomerázy urýchliť izomerizačné reakcie. Toto sú reakcie, v ktorých sú zachované všetky pôvodné atómy v reaktante, ale sú preusporiadané tak, aby vytvorili izomér reaktantu. (Izoméry sú molekuly s rovnakým chemickým vzorcom, ale s rôznym usporiadaním.) Príklady zahŕňajú glukóza-fosfát izomerázu a alanín racemázu.
ligázu (nazývané tiež syntetázy) zvyšujú rýchlosť spojenia dvoch molekúl. Zvyčajne to dosahujú využitím energie získanej z rozkladu adenozíntrifosfátu (ATP). Príklady ligáz zahŕňajú acetyl-CoA syntetázu a DNA ligázu.
Inhibícia enzýmu
Okrem zmien teploty a pH môžu mať iné faktory za následok zníženie alebo zastavenie činnosti enzýmov. V procese nazývanom alosterická interakcia sa tvar enzýmu dočasne zmení, keď sa molekula viaže na jej časť od miesta, kde sa pripája k reaktantu. To vedie k strate funkcie. Niekedy je to užitočné, keď samotný produkt slúži ako alosterický inhibítor, pretože to je zvyčajne znak reakcie, ktorá prebehla do bodu, keď už nie je potrebný ďalší produkt.
Pri kompetitívnej inhibícii látka nazývaná regulačná zlúčenina súťaží s reaktantom o väzobné miesto. Toto je podobné pokusu o vloženie niekoľkých pracovných kľúčov do jedného zámku súčasne. Pokiaľ sa dostatok týchto regulačných zlúčenín spojí s dostatočným množstvom prítomného enzýmu, spomalí alebo zastaví reakčnú cestu. To môže byť užitočné vo farmakológii, pretože mikrobiológovia môžu navrhovať zlúčeniny, ktoré súťažia s väzbovými miestami bakteriálnych enzýmov, čím je pre baktérie oveľa ťažšie spôsobiť ochorenie alebo prežiť v ľudskom tele.
Pri nekompetitívnej inhibícii sa inhibičná molekula viaže na enzým na mieste odlišnom od aktívneho miesta, podobne ako pri alosterickej interakcii. K ireverzibilnej inhibícii dochádza, keď sa inhibítor trvale viaže na enzým alebo ho významne degraduje, takže jeho funkcia sa nemôže obnoviť. Nervový plyn aj penicilín využívajú tento druh inhibície, aj keď s ohľadom na masívne odlišné zámery.