Obsah
Kovalentné väzby a vodíkové väzby sú primárne intermolekulárne sily. Kovalentné väzby sa môžu vyskytovať medzi väčšinou prvkov v periodickej tabuľke. Vodíkové väzby sú špeciálnou väzbou medzi atómom vodíka a atómom kyslíka, dusíka alebo fluóru.
mocnosťou
••• Jupiterimages / Photos.com / Getty ImagesSila prvku kombinovať sa s inými prvkami je vyjadrená priradeným číslom nazývaným valencia. V prípade iónov sa valencia rovná elektrickému náboju. Napríklad, valencia pre chlór je 3p5, takže ľahko získa jeden elektrón a výsledný ión je Cl-.
Octetove pravidlo


Oktetové pravidlo je založené na myšlienke, že konfigurácia vzácneho plynu (s2p6) je najvýhodnejšia a dá sa dosiahnuť vytvorením väzieb elektrónových párov s inými atómami.
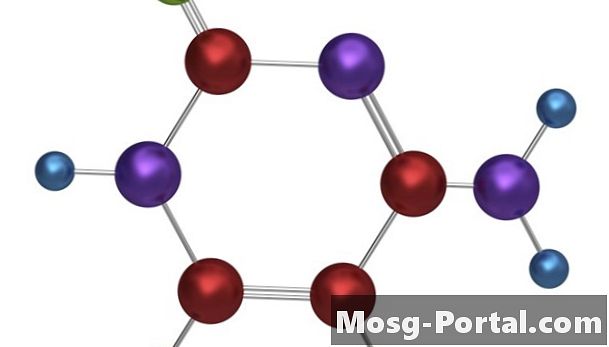
Kovalentné väzby
••• Tempusfugit / iStock / Getty ImagesKovalentné väzby sa vytvárajú, keď dva alebo viac atómov zdieľajú elektróny, aby vyplnili svoje najvzdialenejšie elektrónové puzdrá.
Vodíkové väzby


K vodíkovej väzbe dochádza, keď sa čiastočný kladný náboj atómu vodíka viaže na molekulu elektronegatívu, obvykle na kyslík, dusík alebo fluór.
Kovalentné v. Vodíkové väzby

Kovalentné aj vodíkové väzby sú formou medzimolekulových síl. Kovalentné väzby sa môžu vyskytovať s väčšinou prvkov v periodickej tabuľke, zatiaľ čo vodíkové väzby sa zvyčajne vyskytujú medzi atómom vodíka a molekulou kyslíka, dusíka alebo fluóru. Vodíkové väzby sú tiež len asi 1/10 rovnako silné ako kovalentné väzby.