Obsah
- definícia
- Kyselina etyléndiamíntroctová a potenciometrická metóda
- Komplexometrická titrácia
- Riešenie byrety
Vedci sa spoliehajú na priamu titráciu, aby našli množstvo látky v roztoku s chemickými reakciami. Pri správnom vykonaní môže tento proces veľmi presne znázorniť chemické množstvá pomocou špeciálnych kyselín a laboratórneho skla. Aby titrácia fungovala správne, musí sa posledný komplex vytvoriť dostatočne rýchlo, aby ho vedci mohli analyzovať.
definícia
Priama titrácia je spôsob, ako kvantitatívne určiť obsah látky. Vedci si môžu byť vedomí reaktantu, ale nevedia jeho množstvo. Priama titrácia je niekedy založená na indikátoroch, ktoré reagujú na analyzovaný materiál, ktorý sa nazýva analyt. Inokedy sú spôsoby založené na použití pridaných kovových iónov, ktoré sú jednotlivými atómami alebo molekulami špecifického typu kovu.
Kyselina etyléndiamíntroctová a potenciometrická metóda
Technici môžu vykonávať titráciu pomocou kyseliny etyléndiamíntroctovej s kovovými iónovými indikátormi. Táto metóda nefunguje vo všetkých situáciách, pretože reakcia je niekedy tak pomalá, že titrácia sa stáva nereálnou. Použitý kovový ión musí mať menšiu stabilitu ako analyt. Inou metódou priamej titrácie je potenciometrická metóda, ktorá sa používa na detekciu koncových bodov s kovovými iónmi, ktoré majú špecifické dostupné elektródy. Koncový bod je bod, v ktorom titračný proces končí.
Komplexometrická titrácia
Pri komplexometrickej titrácii vedci používajú na identifikáciu kovov aminopolykarboxylové kyseliny. Farebné komplexy tvoria a vedci používajú údaje zozbierané z tejto formácie na stanovenie množstva analytu. Priama metóda komplexometrickej titrácie zahrnuje použitie roztoku kov-soľ titrovaného roztokom komplexotvornej zlúčeniny. Roztoky komplexných zlúčenín obsahujú atómy alebo zlúčeniny, ktoré tvoria komplexy s inými atómami alebo zlúčeninami. Vedci našli bod ekvivalencie z pridaného ukazovateľa. Bod ekvivalencie je, keď sa pridaný titrant stechiometricky rovná analytu. Stechiometria zahŕňa vyvažovanie chemických reakcií.
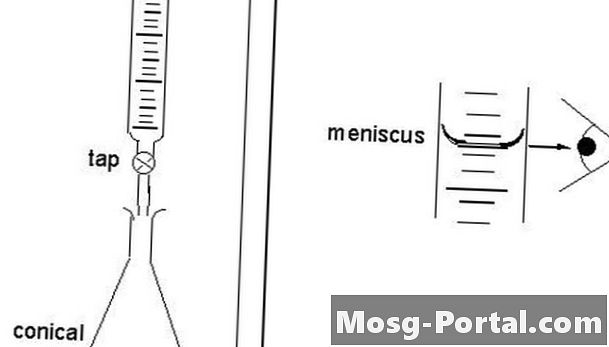
Riešenie byrety
Priama titrácia sa nazýva „priama“, pretože vedec pristupuje priamo ku koncovému bodu. Titrant vstupuje do roztoku kvapkami z byrety, takže konečná kvapka neprekračuje koncový bod. Pri priamej titrácii vedci ošetrujú rozpustnú látku obsiahnutú v roztoku, ktorý je obsiahnutý v nádobe nazývanej titrát. Štandardizovaný roztok sa nazýva titrant. Koncový bod sa stanoví inštrumentálne alebo vizuálne pomocou ukazovateľa. Vedci pridávajú titrant do správnej byrety, zvislého a valcovitého kúska skla s presným kohútikom, ktorý uvoľňuje malé množstvo kvapaliny v konkrétnych množstvách. Vedci naplnia byretu na 30 až 100 percent kapacity.